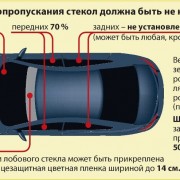
Как подключить стартерную АКБ к ИБП
Содержание:
СВОЙСТВА
 Палладий пластичен, микродобавки никеля, кобальта, родия или рутения улучшают механические свойства Pd, повышают твёрдость.
Палладий пластичен, микродобавки никеля, кобальта, родия или рутения улучшают механические свойства Pd, повышают твёрдость.
В воде нерастворим; плотность — 12,02 (20 °C, г/см³); в особых условиях образует коллоидный палладий и палладиевую чернь. Из всех металлов платиновой группы палладия является самым легкоплавким.Температура плавления — 1554 °C (в некоторых источниках 1552 °C); температура кипения около 2940 °C. Теплота плавления — 37,8 кал/г; удельная теплоёмкость при 20 °C — 0,0586 кал/(г·град); удельное электросопротивление при 25 °C — 9,96 мкОм/см; теплопроводность — 0,161 кал/(см·сек·град). Парамагнетик, то есть, намагничивается во внешнем магнитном поле в направлении этого поля.
В чистом виде палладий обладает красивым серебристо-белым цветом. Как и у всех благородных металлов, его цвет не меняется со временем.
Палладий в чистом виде довольно мягкий металл. Его твердость составляет 373 МПа по Бринеллю, что примерно соответствует твердости платины (392 МПа) и превосходит твердость золота и серебра (245 МПа). Твердость чистого палладия возрастает при холодной обработке ковкой или прокаткой. При отжиге твердость снова уменьшается. Чистый палладий нельзя использовать в ювелирных украшениях, они будут крайне чувствительными к механическим воздействиям. Однако, добавление к палладию небольшого количества других металлов, особенно никеля или рутения, значительно увеличивает его твердость. К примеру, для производства ювелирных изделий в Европе и Северной Америке используется палладий 950 пробы, т.е. украшение содержит 95% чистого палладия. Остальные 5% обычно составляет рутений или медь. В России для изготовления украшений используются сплавы палладия с серебром и никелем 500 или 850 пробы, сплав с медью 850 пробы. Износоустойчивость ювелирных изделий из палладия примерно равна платиновым и выше, чем у золотых и серебряных изделий.
ПРОИСХОЖДЕНИЕ
 Палладий встречается в виде примеси во многих сульфидах и силикатах ультраосновных и основных пород. Некоторые угли обогащены палладием до 10%, повышенная концентрация наблюдается в марганцевых рудах, в фосфоритах, в золе растений. Содержание палладия повышено в ультраосновных породах и породах, содержащих сульфиды Cu, Ni и Te. Обычно находится в природе в виде примеси в самородной платине, с которой образует неупорядоченный твёрдый раствор; иногда встречается в её россыпях в виде окатанных зёрен. Как правило, содержит примеси платины, иридия, золота, серебра. В палладистой платине содержится 19-40% палладия, в палладистой станноплатине -17-21%, в поликсене — до 6%, в ферроплатине — до 13%, в иридистой платине — до 4%. Может находиться также в виде примеси к самородному золоту (в Бразилии, например, найдена редкая разновидность самородного золота (порпецит), с содержанием 8-11% палладия). Формируется в зоне окисления коренных источников платины и непосредственно в россыпях в результате гипергенного преобразования платиновых минералов. В железных метеоритах на тонну вещества приходится до 7,7 гр. палладия, в каменных — до 3,5 гр.
Палладий встречается в виде примеси во многих сульфидах и силикатах ультраосновных и основных пород. Некоторые угли обогащены палладием до 10%, повышенная концентрация наблюдается в марганцевых рудах, в фосфоритах, в золе растений. Содержание палладия повышено в ультраосновных породах и породах, содержащих сульфиды Cu, Ni и Te. Обычно находится в природе в виде примеси в самородной платине, с которой образует неупорядоченный твёрдый раствор; иногда встречается в её россыпях в виде окатанных зёрен. Как правило, содержит примеси платины, иридия, золота, серебра. В палладистой платине содержится 19-40% палладия, в палладистой станноплатине -17-21%, в поликсене — до 6%, в ферроплатине — до 13%, в иридистой платине — до 4%. Может находиться также в виде примеси к самородному золоту (в Бразилии, например, найдена редкая разновидность самородного золота (порпецит), с содержанием 8-11% палладия). Формируется в зоне окисления коренных источников платины и непосредственно в россыпях в результате гипергенного преобразования платиновых минералов. В железных метеоритах на тонну вещества приходится до 7,7 гр. палладия, в каменных — до 3,5 гр.
Поскольку россыпные месторождения cамородного палладия весьма редки, основным сырьём для его попутного получения служат сульфидные руды никеля и меди (Норильский р-н и др.)
Платиновый катализатор
Платиновые катализаторы имеют сравнительно большую рабочую поверхность, которая слагается из поверхности всех нитей сетки, приходящихся на единицу площади массы сетки катализатора. Так, при диаметре платиновой проволоки, равном 0 09 мм, и числе сплетений ( отверстий) в 1 см2 1024 исходная поверхность состав-ляет 2 3 14 0 009 У1024 1 809 см2 для 1 см2 сетки. В процессе работы катализатора в контактном аппарате фактическая поверхность проволоки возрастает в десятки раз, однако все расчеты ведут на исходную поверхность.
Платиновый катализатор, по сравнению с алюмо-молибденовым и др. окисными катализаторами, обладает рядом преимуществ и в первую очередь долгое время сохраняет свою активность, а также дает больший выход ароматич.
Платиновые катализаторы изготовляются в виде волнистой или мятой тонкой пластинки, тампона из тонких — нитей диаметром около 0 02 миллиметра или сетки из нитей диаметрам от 0 025 до 0 075 миллиметра с числом петель от 1000 до 3600 на один квадратный сантиметр. Чаще всего применяют несколько плоских сеток, расположенных параллельно на небольшом расстоянии друг от Друга.
|
Степень окисления NH3 до NO и N2 на платиновых катализаторах в зависимости от температуры при 1 am.| Степень окисления аммиака на платиновых катализаторах до NO и N2 в зависимости от времени контакта при 1 am. |
Платиновые катализаторы очень чувствительны к действию ядов и необратимо отравляются следами фосфористого водорода: их активность быстро понижается от ничтожного количества паров смазочных масел, сероводорода, пыли ( особенно частиц железа и его окиси) и др. Поэтому аммиак и воздух, идущие в контактный аппарат, должны быть тщательно очищены от примесей.
Платиновый катализатор получают обычно из растворов H2PtCle и ее солей химическим или электрохимическим осаждением.
|
Влияние объема катализатора ( 0 1 % Pt / Al2O3 на устойчивость против отравления свинцом ( срь в газах 0 6 г / л.| Устойчивость платины ( 1 и палладия ( 2 к свинцовому отравлению при 550 С ( срь 0 08 г / л, катализатор 0 1 % М / А12ОЭ. |
Платиновые катализаторы, отравленные свинцом, частично восстанавливают свою активность при переходе на тонливо, не содержащее свинец или содержащее его в меньшем количестве. Анализ регенерированного катализатора показывает, что содержание свинца резко уменьшается на внешней поверхности зерен катализатора, но увеличивается внутри зерен, т.е. в процессе регенерации происходит проникновение свинца с поверхности зерен катализатора в их объем. Наряду с этим происходит разложение сульфата свинца, и сера улетучивается. Поскольку при регенерации свинец не удаляется, последующий контакт катализатора с отработавшими газами, содержащими свинец, приводит к более быстрому и более глубокому отравлению.
|
Зависимость выхода окиси азота от температуры.| Зависимость степени окисления аммиака от времени соприкосновения при 900 С, постоянном отношении О2. NH3 2 и содержании. |
Платиновый катализатор очень чувствителен к примесям, обычно присутствующим в воздухе и аммиаке. Наиболее сильное влияние оказывает фосфористый водород. При содержании его в аммиачно-воздушной смеси 2 — 10 — 5 % степень окисления аммиака снижается на 80 %, при этом отравление катализатора является необратимым. Вредное действие оказывают также соединения серы и некоторые другие вещества; при содержании в газовой смеси 1 % сероводорода активность платины снижается на несколько процентов.
Платиновый катализатор содержит прочно адсорбированный водород, не вытесняемый питросоединснием, поэтому скорость реакции зависит от активности самого нитрососдипеншг.
Платиновые катализаторы используют в виде сеток, черней и нанесенными на носители.
Платиновые катализаторы весьма чувствительны к некоторым1 примесям, могущим присутствовать в обжиговых газах. Под дей — ствием этих примесей-ядов — катализатор теряет активность — отравляется. При этом первые порции яда часто вызывают зна — чительно большее снижение активности платины, чем последующие.
Платиновые катализаторы применяются в количествах, отвечающих 0 2 кг платины на 1 т суточной выработки. Отсюда следует, что единовременные затраты на платину в 10 раз превышают затраты на пятиокись ванадия.
Платиновые катализаторы весьма чувствительны к некоторым примесям, могущим присутствовать в обжиговых газах. Под действием этих примесей-ядов — катализатор теряет активность — отравляется. При этом первые порции яда часто вызывают значительно большее снижение активности платины, чем последующие.
Химические свойства
Палладий уникален в своём роде с точки зрения строения наружной электронной оболочки. Она заполнена полностью, поэтому металл наделен невероятно высокой химической стойкостью. Однако противостоять действию сильных окислителей Pd в состоянии лишь до уровня в 500°С. Палладий участвует в образовании огромного числа комплексных соединений, которые широко применяются в различных отраслях промышленности.
Очевидно, что такой металл не могла обойти стороной ювелирная промышленность. Палладий очень красив, особенно в сочетании с камнями, никогда не тускнет и отлично обрабатывается. Этот металл используется для «отбеливания» золота: доля палладия в белом золоте составляет 1/7 часть.
Pd относительно дешёв, поэтому является наиболее доступным из всей линейки платиновых металлов. Если же учесть, что палладий наделен основными свойствами элементов данной группы, с его помощью удается значительно удешевить производство различных изделий, к примеру, зубных протезов или некоторых деталей сложной электротехники.
Еще одно интересное качество палладия – его реакция на контакт с угарным газом. Как известно окись углерода CO является крайне опасным ядом, не имеющим запаха, цвета и вкуса. Обычная бумажка, смоченная в растворе хлористого палладия, моментально отреагирует на превышение содержания CO в воздухе (свыше 0,02 мг/л): она почернеет, поскольку в контакте с СО соединение PdCl 2 начинает восстанавливаться в палладиевую чернь.
Используется палладий и в противогазах: небольшая добавка Pd выступает здесь в роли простейшего катализатора доокисления воздуха.
Отравление — платиновый катализатор
|
Влияние свинца на конверсию углеводородов на алюмоплатиновом катализаторе ( 1000см3 0 1 % Pt / Al2O3 при обезвреживании отработавших газов ( ОГ автомобилей при 550 С ( состав ОГ. углеводороды-0 06. СО-0. 3. О2 — 2 0. NO-01 %.| Техническая характеристика нейтрализаторов типа КН. |
Отравление платинового катализатора свинцом вызвано отложением сульфата свинца. Как видно из рис. 31, наибольшая часть свинца, как и серы, концентрируется во внешних слоях зерен катализатора.
Отравление платиновых катализаторов хлором и хлористым водородом обратимо. После прекращения подачи яда первоначальная активность через некоторое время восстанавливается.
Отравление платиновых катализаторов в производственных условиях вызывается чаще всего присутствием в газах соединений мышьяка.
Отравление платиновых катализаторов хлором и хлористым водородом обратимо. После прекращения подачи яда первоначальная активность через некоторое время восстанавливается.
Отравление платиновых катализаторов в производственных условиях вызывается чаще всего присутствием в газах соединений мышьяка.
Отравление платинового катализатора водородом для реакции разложения аммиака без ингибирования разложения йодистого водорода часто приводилось в качестве примера селективного отравления, и его истолковывали как указание на то, что эти две реакции протекают на различных центрах. При разложении аммиака атомы азота должны быть присоединены к поверхности, и легко убедиться в том, что сильная адсорбция водорода может предотвратить эту хемосорбцию. Но при разложении йодистого водорода может случиться так, что хемосорбированные атомы водорода взаимодействуют с соударяющимися с ними молекулами йодистого водорода из газовой фазы или с молекулами из вандерваальсового слоя. Свободные атомы водорода легко атакуют йодистый водород, труднее — аммиак, и поэтому маловероятно, что атомы на поверхности имеют такие же относительные скорости взаимодействия.
Сероводород вызывает отравление платиновых катализаторов при окислении аммиака и при многих других каталитических реакциях. Данных о вредном влиянии сероводорода на платиновые катализаторы в условиях контактного окисления двуокиси серы не имеется.
Эффективная и истинная кривые отравления платинового катализатора ( 0 05 г Pt) гидрирования, отравленного циан-ионами.
Мэкстед с со грудниками подробно изучали отравление платиновых катализаторов и в некоторых случаях нашли, что вначале активность уменьшается в зависимости от увеличения концентрации яда линейно, а затем падает более медленно.
Было установлено, какие примеси в газе вызывают отравление платиновых катализаторов, и найдены пути очистки газов от этих ядов. Кроме того, были получены данные о зависимости равновесной степени превращения SO3 в SO3 от состава газовой смеси и температуры, а также о влиянии этих факторов на кинетику контактного процесса на платине.
Этот новый полученный нами факт позволяет согласовать результаты исследования отравления платиновых катализаторов в условиях риформинга с результатами, представленными, например, в известной работе Мэкстеда , посвященной отравлению платиновых катализаторов в условиях жидкофазного гидрирования непредельных соединений.
Промышленное внедрение контактного метода задерживалось также тем, что долгое время точно не знали причин отравления платинового катализатора.
Внедрение контактного метода в промышленность задерживалось вследствие того, что в течение долгого времени не удавалось точно установить причины отравления платинового катализатора.
Внедрение контактного метода в промышленность задерживалось также вследствие того, что в течение долгого времени не были точно установлены причины отравления платинового катализатора.
Применение — платиновый катализатор
В табл. 77 указаны выходы, октановые числа и распределение продуктов, полученные при использовании в качестве сырья трех различных лигроинов, отличающихся содержанием парафиновых углеводородов и серы. Исследования, которые проводились каждый раз в присутствии свежей порции катализатора, показали, что регенеративный процесс с применением платинового катализатора дает возможность получать бензин с более высоким ( на 4 — 6 %) выходом.
На основе их созданы воздушно-метанольяые ЭХГ небольшой мощности. Метанольные ЭХГ характеризуются достаточно высокой удельной энергией, однако применение их сдерживается некоторыми их недостатками: карбонизацией щелочного электролита, необходимостью применения платиновых катализаторов, малыми удельными мощностями элементов с кислыми электролитами.
Для процесса каталитического риформинга предложено много различных катализаторов. Широкое промышленное применение получили алюмоплатиновый ( платина, нанесенная на окись алюминия с различными добавками) и окисномолибдено-вый ( окись молибдена, нанесенная на окись алюминия) катализаторы. Широко развивается каталитический риформинг с применением наиболее эффективного платинового катализатора.
|
Кинетические кривые восстановления ос — и ( 3-хлорофиллов. Ряд 1 — для ос-хлорофилла. ряд 2 — для ( 3-хлорофилла. Выделены и установлено строение продуктов на каждой ступени реакции восстановления ос — и ( 3-хлорофиллов ( схема 2. |
Исходя из этого изучено их поведение в реакции гидрирования. В качестве катализаторов были испытаны Ni-Ренея, Pd и Pt на угле. Однако, восстановление хлорофилла и соланидина практически на этих катализаторах не проходило, и только после применения специально полученного платинового катализатора удалось провести реакции их гидрирования.
Гомологи бензола являются весьма ценными составными частями авиационного бензина, так как имеют высокие октановые числа. В последнее время в США разработан новый каталитический метод ароматизации бензинов, содержащих нафтеновые углеводороды СвН1г, C7HU и С8Н16, с применением платиновых катализаторов, открытых Н. Д. Зелинским еще в 1911 г. Этот процесс, названный платформингом, получил весьма быстрое распространение и начинает вытеснять другие каталитические методы ароматизации.
Реакции ( а) — ( г) практически необратимы и поэтому направление процесса определяется соотношением скоростей реакций. Для производства азотной кислоты необходимо наиболее полное окисление аммиака по реакции ( а), поэтому применяют катализаторы, избирательно ускоряющие ее. Процесс окисления проходит только при высоких температурах, однако излишне высокая температура ( свыше 900 С) приводит к образованию элементарного азота. В качестве избирательных катализаторов, ускоряющих процесс окисления аммиака до окиси азота, могут служить платина и ее сплавы с металлами платиновой группы, окислы железа, марганца, кобальта и др. До настоящего времени платина и ее сплавы являются непревзойденными по своей активности катализаторами для этой реакции. Поэтому большинство заводов, производящих азотную кислоту из аммиака, работает с применением платиновых катализаторов. Неплатиновые катализаторы, хотя и менее активные, но более дешевые также широко применяются во второй стадии окисления аммиака.
Биметаллический катализатор
Биметаллические катализаторы могут быть разделены на два широких класса: нанесенные и ненанесенные.
Биметаллические катализаторы для таких реакций впервые были применены в двух областях: для переработки или очистки малосернистых жидких продуктов гидрогенизации каменного угля до чистых топлив и для реакций синтеза и.
Биметаллические катализаторы возможно применять на различных стадиях переработки угля при невысокой концентрации сернистых соединений. Их изучение в течение последних пяти — десяти лет привело к созданию катализаторов с контролируемыми свойствами: активностью и селективностью, повышенными термостабильностью и сроком эксплуатации.
Биметаллические катализаторы могут найти применение также для предупреждения отложений углерода и увеличения термостабильности. Пока не разработан высокоселективный катализатор, проблема обеспечения термостойкой стабильности имеет только второстепенное значение.
|
Основные показатели работы установок. |
Биметаллические катализаторы более активны и стабильны. В их присутствии селективность дегидроциклизации парафинов повышается до 70 %, что значительно увеличивает выход ароматических углеводородов. Наличие второго металла в составе катализатора препятствует агломерации платины на поверхности носителя и снижению ее дегидрирующей активности.
Другой биметаллический катализатор, содержащий кроме платины германий, теряет значительную часть своей активности, так как образующийся в присутствии сернистых соединений в сырье сульфид германия при 450 С возгоняется. Имеются сообщения о том; что при работе на би — и полиметаллических катализаторах температура конца кипения сырья может быть повышена до 225 С.
|
Зависимость выхода бензина ( Г и содержания в нем ароматических углеводородов ( 2 от температуры при риформинге фракции 100 — 180 С. |
Применение биметаллических катализаторов позволяет наряду с уменьшением давления в системе снизить циркуляцию водород-содержащего газа; такое снижение следует также применять при переработке сырья с высоким содержанием нафтеновых углеводородов, так как подавление реакции их дегидрирования уменьшает выход риформата.
Из биметаллических катализаторов платино-иридиевый превосходит по стабильности и активности в реакциях дегидроциклизации парафинов не только монометаллический, но и платино-рениевыи катализатор.
Недостатками биметаллических катализаторов являются повышенная чувствительность к сернистым ядам ( трудности даже при содержании 3 ррт серы в сырье) и необходимость предотвращать вымывание водой хлора из носителя, которое усиливается жесткими условиями риформинга на биметаллических катализаторах.
Проблемы биметаллических катализаторов при проведении окислительной регенерации значительно сложнее. Во-первых, это — общая проблема, которая возникает при регенерации всех нанесенных металлических катализаторов, а именно — необходимость возможно более полного устранения спекания металлического компонента. Спекание происходит даже при тщательном контролировании выжигания углерода, при низких концентрациях кислорода. После нескольких циклов регенерации кристаллы вырастают в размерах, что приводит к уменьшению поверхности активного металла и поэтому к снижению активности
Весьма важно, что у биметаллических катализаторов происходит при этом изменение в поверхностном составе и фазовая сегрегация или разделение кристаллов с увеличением их размеров.
Изучение биметаллических катализаторов Изучение методом РРА многокомпонентных высокодисперсных катализаторов в значительной с тепе ни осложнено наложением межатомных расстояний различных фаз.
Преимущества биметаллических катализаторов связаны в первую очередь с их повышенной устойчивостью к закоксовыванию.
К биметаллическим катализаторам относится платино-рениевый, в котором на тех же носителях находятся оба металла в количествах, примерно равных ( по — 0 4 % мае. Присутствие второго металла ( рения) препятствует рекристаллизации платины — укрупнению ее кристаллитов с течением времени и, соответственно, уменьшению числа ее активных центров.
Железный катализатор
Железные катализаторы с добавками Zn, Ai203, щелочей и других веществ получаются мало активными. Активность их несколько повышается в случае восстановления водородом при температурах около 300 — 400 С.
Железный катализатор должен быть обязательно восстановлен водородом; не исключено, повидимому, в отдельных случаях применение для восстановления и окиси углерода, а также смеси окиси, углерода и водорода.
Железные катализаторы с добавкой различных окислов металлов, восстанавливаемые при температуре до 840 С, активны только при синтезе под давлением. Эти катализаторы позволяют осуществлять синтез с значительно большей объемной скоростью и производительностью.
Железные катализаторы работают в восстановленном состоянии, температура восстановления 500 С. Процесс восстановления длителен и продолжается около 7 суток.
Железный катализатор, полученный при восстановлении водородом магнетита или прокатной окалины, и промотированный окисью калия, эффективен при 204 — 260 С. Допустимые объемные скорости почти прямо пропорциональны давлению.
Железные катализаторы ( осажденные и плавленые), промо-тированные различными добавками ( главным образом, щелочными металлами Na, К, Rb), применяют при производстве углеводородов и моторных топлив.
Железный катализатор, применяемый для жидкофазной гидрогенизации смол, нефтяных остатков и других подобных продуктов, представляет собой гидрат окиси железа, нанесенный на активный носитель. Носителем обычно служит пылевидный унос из газогенератора, получающийся при газификации угля в кипящем слое на парокислородном дутье. Применяемый носитель характеризуется определенной величиной поверхности его частиц и должен содержать 50 — 60 % углерода и 40 — 45 % золы.
Железные катализаторы в отличие от кобальтовых вследствие того, что синтез над ними протекает при более высоких температурах, легко подвержены при этом окислению кислородом воды в случае отсутствия в газе избытка окиси углерода. При наличии в газе избыточных количеств окиси углерода окисления катализатора не происходит, так как образующаяся вода реагирует с окисью углерода с образованием углекислоты и водорода. Скорость реакции конверсии при температурах синтеза значительно выше скорости окисления, поэтому высокая концентрация окиси углерода в синтез-газе и способность катализатора ускорить конверсию окиси углерода водой предохраняет катализатор от окисления и снижения его активности.
Железные катализаторы при восстановлении при высоких температурах ( 500 и выше) спекаются, приобретая металлический блеск.
Железные катализаторы, сплавные или осажденные, с добавкой различных окислов металлов, восстанавливаемые при температуре до 840, активны только при синтезе под давлением. Эти катализаторы позволяют осуществлять синтез со значительно большей объемной скоростью и производительностью.
|
Результаты синтеза над железо-медным катализатором, высаженным. |
Железные катализаторы без меди или с небольшой присадкой меди в зависимости от условий их изготовления позволяют при давлении 15 — 30 ат вести синтез С различными объемными скоростями от 100 до 1000 и выше с рециркуляцией газа.
Железные катализаторы более эффективны, и существенным их преимуществом по сравнению с кобальтовыми катализаторами является возможность придания процессу синтеза большей гибкости. Изменяя состав катализатора, метод его приготовления и восстановления, можно управлять реакцией синтеза углеводородов. Кроме того, железные катализаторы высокопроизводительны и достаточно дешевы.
Железные катализаторы получают в разнообразных условиях. Этот катализатор при 330 и 15 am на смеси СО: Н — 1: 1 2 дает 130 г жидких и твердых углеводородов на 1 м3 газа. Предварительная обработка синтгазом ( газовая смесь, идущая на синтез) повышает активность и длительность работы катализаторов. Достаточно активны для синтеза углеводородов и железные катализаторы типа аммиачных.
Железный катализатор применяют без носителей. Для этой цели пригоден обычный катализатор синтеза аммиака, а также контакты, полученные методом осаждения или непосредственно из магнетитовых руд, и катализатор, приготовленный окислением железа ( стружек) водяным паром. Восстановление до металлического железа осуществляется водородом при 400 — 500 С. В контакте тоже оставляют 0 1 — 0 5 % щелочи.
Активность — платиновый катализатор
|
Реактор блока гидроочистки установки каталитического рифор.| Реактор блока установки каталитического риформинга. |
Активность платинового катализатора вследствие отложений на нем кокса со временем падает. Для ее восстановления производится выжиг кокса с поверхности катализатора смесью инертного газа и воздуха под давлением 10 ат в три ступени. Температура регенерации в первой ступени составляет 300 — 350 С, во второй 380 — 420 С, в третьей 450 — 500 С.
Установлено, что активность платинового катализатора существенно зависит от условий его обработки. Наибольшей каталитической активностью при разложении ЬЬСЬ обладает не сама платина, а кислородные соединения, образующиеся на ее поверхности.
При удачном подборе фосфина активность платинового катализатора может превысить активность родиевого катализатора, хотя при этом заметно возрастает количество образующихся побочных продуктов.
Предполагается, что падение активности платиновых катализаторов происходит за счет ионизации атомов платины и закрепления валентного электрона на ловушечном уровне носителя.
Предполагается, что падение активности платиновых катализаторов происходит за счет ионизации атомов платины и закрепления валентного электр.
В случае переработки нефтяных фракций при атмосферном давлении активность платиновых катализаторов быстро снижается. Установлено, что характер отравления катализатора не зависит от строения сернистого соединения. Для подавления активности катализаторов на 70 — 80 % достаточно 6 — 7 вес.
Размер кристаллов платины в АПК оказывает значительное влияние на активность платиновых катализаторов в реакциях превращения углеводородов.
Тейлор и Кеппс исследовали влияние различных газообразных ядов на активность платиновых катализаторов, применяемых при окислении аммиака в окислы азота, и нашли, что сероводород не оказывает заметного действия.
После предварительной очистки сырья с целью снижения содержания серы и азота активность платиновых катализаторов этого типа повышается и одновременно уменьшается количество образующихся легких углеводородов.
Содержащиеся в сырье платформинга органические соединения двухвалентной серы оказывают сильное влияние на активность платиновых катализаторов. Влияние природы сераорганических соединений на активность платиновых катализаторов изучено недостаточно; в немногих работах, посвященных этому вопросу, высказываются противоречивые мнения.
Содержащиеся it сырье платформинга органические соединения двухвалентной серы оказывают сильное влияние на активность платиновых катализаторов. Влияние природы сераорганических соединений на активность платиновых катализаторов изучено недостаточно; в немногих работах, посвященных этому вопросу, высказываются противоречивые мнения.
Сера — селективным яд, который при контролируемом осернеМии в достаточной мере избирательно подавляет активность платиновых катализаторов реформинга в реакции гидрогенолиза парафинов. Следствием является повышение селективности каталитического ри-форминга , в частности увеличение выхода ароматических углеводородов ( а. Биметаллические катализаторы, содержащие германий, олово и свинец, не требуют осернения, так как эти металлы подавляют гидрогенолиз.
Как было указано в разделе, посвященном бифункциональным катализаторам риформинга, регулирование кислотности носителя позволяет увеличить гидроизомеризующую активность платиновых катализаторов. Ряд катализаторов, основанных на этом принципе, уже применяется в промышленных процессах или находится в стадии разработки.
При определении активности оживленного катализатора по отношению к гидрированию было найдено, что она имеет один порядок с активностью свежеприготовленных неотравленных платиновых катализаторов.