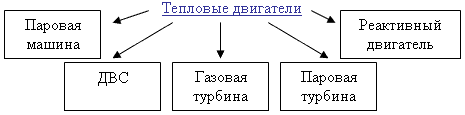
Теплоемкость
Содержание:
Максимальная и минимальная теплоты процесса
Уравнения первого закона термодинамики
в сложных закрытых ТС при двух фиксированных
параметрах имеют вид:
— для изохорно-изотермического процесса
(T,V=const): ℒТ,V;
ℒТ,V;
— для изобарно-изотермического процесса
(T,p=const):
ℒТ,р.
При написании этих уравнений использовалось
правило знаков, принятое в термодинамике,
т.е.
 ,
,
если теплота подводится к ТС, и ℒ>0,
ℒ>0,
если работа совершается термодинамической
системой. В термохимии принято
противоположное правило знаков для
теплоты, т.е. теплота ,
,
(положительна), если она отводится от
ТС. Тогда для конечных процессов 1-2
уравнение 1-го закона термодинамики
будет иметь вид:
 ℒТ,V, (1)
ℒТ,V, (1)
 ℒТ,р, (2)
ℒТ,р, (2)
Соотношения (1) и (2) справедливы для любых
процессов, обратимых и необратимых.
Для обратимого процесса
ℒ=ℒmax ,
 :
:
 ℒТ,V
ℒТ,V
max, (3)
 ℒТ,p
ℒТ,p
max, (4)
Для максимально возможного необратимого
процесса ℒ=ℒmin=0,
 :
:
 , (5)
, (5)
 .(6)
.(6)
Соотношения (5) и (6) используются в
химической термодинамике для расчета
изохорного и изобарного тепловых
эффектов химических реакций (ТЭХР). В
этом случае работа ℒmaxпреобразуется в тепловую энергию
неупорядоченного движения частиц (в
теплоту и
и ).
).
В случае обратимого равновесного
процесса перераспределения масс
(уравнения (3) и (4)) величины
 и
и — это количества теплоты, которыми ТС
— это количества теплоты, которыми ТС
обменивается с окружающей средой в
процессах и
и .ℒТ,VmaxиℒТ,pmax— максимальные количества работы
.ℒТ,VmaxиℒТ,pmax— максимальные количества работы
немеханического характера, которые
могут быть получены от ТС в процессах и
и .
.
В случае необратимого процесса
перераспределения массы в соответствии
со вторым законом термодинамики работа
ℒmaxпреобразуется в теплоту, количество
которого равно изменению внутренней
энергии в процессе
в процессе ,
,
или изменению энтальпии в процессе
в процессе ,
,
протекающем в сложных термодинамических
системах.
Химические реакции, при которых теплота
отводится от термодинамической системы
 ,
,
чтобы конечные продукты имели ту же
температуру, что и начальные реагенты,
называются экзотермическими химическими
реакциями. Химические реакции,
сопровождающиеся поглощением теплоты ,
,
приT=const, называются эндотермическими химическими
реакциями.
Рассмотрим два примера: 1. разрядка
химического источника электроэнергии
(аккумулятор, батарея карманного фонаря)
– процесс обратимый: ℒТ,pmax— преобразуется в электрическую энергию,
а — отводится от системы. 2. Если замкнуть
— отводится от системы. 2. Если замкнуть
клеммы батареи накоротко, то получим
максимально необратимый процесс:ℒ ,
, .
.
Краткая теория и методика выполнения работы
Удельной
теплоемкостью
вещества называется величина, равная
количеству теплоты, которую необходимо
сообщить единице массы вещества для
увеличения ее температуры на один градус
Кельвина:
 . (4.1)
. (4.1)
Теплоемкость
одного моля вещества называется молярной
теплоемкостью:
 , (4.2)
, (4.2)
где
m – масса, µ – молярная масса вещества,
 – число молей газа.
– число молей газа.
Значение
теплоемкости газов зависит от условий
их нагревания. В соответствии с первым
законом термодинамики количество
теплоты
 ,
,
сообщенное системе, расходуется на
увеличение ее внутренней энергии и на совершение системой работы
и на совершение системой работы против внешних сил:
против внешних сил:
 . (4.3)
. (4.3)
Изменение
внутренней энергии идеального газа в
случае изменения его температуры
 равно:
равно:
 , (4.4)
, (4.4)
здесь
– число степеней свободы молекулы газа,
под которым подразумевается число
независимых координат, полностью
определяющих положение молекулы в
пространстве; – универсальная газовая постоянная.
– универсальная газовая постоянная.
При
расширении газа система совершает
работу:
 . (4.5)
. (4.5)
Если
газ нагревать при постоянном объеме
( ),
),
то и, согласно (4.3), все полученное газом
и, согласно (4.3), все полученное газом
количество теплоты расходуется только
на увеличение его внутренней энергии .
.
Следовательно, учитывая (4.4), молярная
теплоемкость идеального газа при
постоянном объеме будет равна:
 . (4.6)
. (4.6)
Если
газ нагревать при постоянном давление
( ),
),
то полученное газом количество теплоты
расходуется на увеличение его внутренней
энергии и совершение газом работы
и совершение газом работы :
:
 .
.
Тогда
молярная теплоемкость идеального газа
при постоянном давлении определяется
следующим образом:
 . (4.7)
. (4.7)
Используя
уравнение состояния идеального газа
(уравнение Клапейрона–Менделеева)
 ,
,
можно показать, что для одного моля газа
справедливо соотношение:
 ,
,
поэтому:
 .
.
Последнее выражение
называют уравнением Майера. Из него,
учитывая (4.6), получаем:
 . (4.8)
. (4.8)
Отношение
теплоемкостей
 обозначаюти называют показателем адиабаты или
обозначаюти называют показателем адиабаты или
коэффициентом Пуассона:
 . (4.9)
. (4.9)
Адиабатным
называется процесс, протекающий в
термоизолированной системе, т.е. без
теплообмена с окружающей средой,
 .
.
На
практике он может быть осуществлен в
системе, окруженной теплоизоляционной
оболочкой, но поскольку для теплообмена
необходимо некоторое время, то адиабатным
можно считать также процесс, который
протекает так быстро, что система не
успевает вступить в теплообмен с
окружающей средой.
Первый
закон термодинамики для адиабатного
процесса имеет вид
 .
.
Знак минус говорит о том, что при
адиабатном процессе система может
совершать работу только за счет внутренней
энергии. С учетом (4.4)–(4.6) имеем:
 . (4.10)
. (4.10)
Продифференцировав
уравнение Клапейрона–Менделеева,
получим:
 .
.
Выразим
из него
 и подставим в формулу (4.10):
и подставим в формулу (4.10):
 .
.
Выразив
 из уравнения Майера и учитывая соотношение
из уравнения Майера и учитывая соотношение
(4.8), получим:
 .
.
Интегрируя
данное дифференциальное уравнение при
условии получим выражение:
получим выражение:
 .
.
(4.11)
Уравнение
(4.11) называется уравнением адиабаты или
уравнением Пуассона.
Метод
определения показателя адиабаты,
предложенный Клеманом и Дезормом (1819
г.), основывается на изучении параметров
некоторой массы газа, переходящей из
одного состояния в другое двумя
последовательными процессами –
адиабатным и изохорным. Эти процессы
на диаграмме
 –
– (рис. 4.1) изображены кривыми соответственно
(рис. 4.1) изображены кривыми соответственно
1–2 и 2–3.
Если
в сосуд, соединенный с дифференциальным
датчиком давления, накачать воздух и
подождать до установления теплового
равновесия с окружающей средой, то в
этом начальном состоянии 1 газ имеет
параметры
 ,
, ,
, ,
,
причем температура газа в сосуде равна
температуре окружающей среды ,
,
а давление немного больше атмосферного.
немного больше атмосферного.
Если
теперь на короткое время соединить
сосуд с атмосферой, то произойдет
адиабатное расширение воздуха. При этом
воздух в сосуде перейдет в состояние
2, его давление понизится до атмосферного
 .
.
Масса воздуха, оставшегося в сосуде,
которая в состоянии 1 занимала часть
объема сосуда, расширяясь, займет весь
объем .
.
При этом температура воздуха, оставшегося
в сосуде, понизится до .
.
Поскольку процесс 1–2 – адиабатный, к
нему можно применить уравнение Пуассона
(4.11):
 или
или
 .
.
Отсюда:
 . (4.12)
. (4.12)
После
кратковременного соединения сосуда с
атмосферой охлажденный из-за адиабатного
расширения воздух в сосуде будет
нагреваться (процесс 2–3) до температуры
окружающей среды
 при постоянном объеме
при постоянном объеме .
.
При этом давление в сосуде поднимется
до .
.
Поскольку
процесс 2–3 – изохорный, к нему можно
применить закон Шарля:
 или
или
 . (4.13)
. (4.13)
Из уравнений (4.12)
и (4.13) получим:
 .
.
Прологарифмируем
это выражение:
 .
.
Поскольку
избыточные давления
 и
и очень малы по сравнению с атмосферным
очень малы по сравнению с атмосферным
давлением ,
,
а также учитывая, что при
 ,
,
будем иметь:
 .
.
Откуда:
 . (4.14)
. (4.14)
Избыточные
давления
 и
и измеряют с помощью дифференциального
измеряют с помощью дифференциального
датчика давления.
Лабораторная работа 3 Исследование изохорного процесса
Процесс, который
происходит при постоянном объёме,
называется изохорным. Математическая
связь между параметрами в изохорном
процессе определяется законом Шарля:
 или
или
 (3.1)
(3.1)
т.е.
при постоянном объёме давление газа
изменяется прямопропорционально его
абсолютной температуре, изохоры показаны
на диаграммах рис.16. Процесс П-1
– изохорный подвод теплоты, П-2
– изохорный отвод теплоты. Уравнение
первого закона термодинамики для
изохорного процесса имеет вид (работа
не выполняется
 )
)

 (3.2)
(3.2)
Количество
теплоты и изменение внутренней энергии
в изохорном процессе определяется по
формуле ( при CV=const)

(3.3)

Рис.16
Таким
образом, вся полученная теплота в
изохорном процессе расходуется только
на изменение внутренней энергии. В T-sдиаграмме
площадь под процессом П
–1 равна
теплоте процесса ( пл
пл
П-1-3-4 ).
При
незначительных изменениях температур,
которые имеют место в опытах, зависимостью
теплоёмкости от температуры можно
пренебрегать, среднюю изохорную
теплоёмкость воздуха можно считать
постоянной
 кДж/кгK
кДж/кгK
(3.4)
Описание установки
Схема установки
для проведения опытов показана на
рис.17. Опыт проводится с воздухом, который
находится в середине герметичной
посудины 7. Посудина 7 погружена в воду,
которая налита в термостат 12. Температура
воды в термостате увеличивается
электронагревателем 9. Значение
температуры воды задаётся электроконтактным
термометром 10. При достижении заданной
температуры воды, нагреватель выключается,
сигнальная лампочка 11 гаснет. Равномерность
температуры воды обеспечивается
электромешалкой 6. Избыточное
(манометрическое) давление измеряется
манометром 5. Температура воздуха
определяется с помощью термопары,
горячий спай 7 которой расположен в
середине герметичной посудины, а холодный
2 – в пробирке с маслом 1. Показания
термопары измеряется цифровым вольтметром
4. Температуру холодного спая 2 измеряют
термометром 3.

Рис.17 Схема установки
для исследования изохорного процесса.
Выполнение работы.
1.
Первый отсчёт выполняют при выключенном
электронагревателе термостата. При
этом фиксируют показания манометра 5
Рман,
давление окружающей среды Ратм
–
барометром, ЭДС термопары – вольтметром.
ЭДС позволяет определить температуру
воздуха в посудине.
2.
Устанавливают на электроконтактном
термометре 10 температуру на 5оС
больше, чем предыдущую, включают
нагреватель термостата 9. Когда температура
воды достигает заданной, гаснет сигнальная
лампочка 11. После этого начинают
фиксировать показания термопары
вольтметром через каждые две минуты.
Окончательное значение показаний
вольтметра и манометра фиксируют тогда,
когда предыдущие и дальнейшие показания
термопары будут одинаковыми.
3.
Устанавливают на электроконтактном
термометре последовательно ещё 4 значения
температур через каждые 5оС
и измеряют ЭДС термопары и избыточное
давление.
Обработка результатов работы
1. Результаты
измерений и расчётов заносят в таблицу
3
Таблица 3
| № п/п | Наименование | Формула | Размерность | Числовые значения |
|||
| 1 | Избыточное давление |
 |
 |
||||
 |
|||||||
| 2 | Атмосферное давление |
Ратм |  |
||||
| мм рт. ст. | |||||||
| 3 | Абсолютное давление |
 |
 |
||||
| 4 | ЭДС термопары |  |
 |
||||
| 5 | ЭДС холодного спая |
 |
|||||
| 6 | ЭДС гарячего спая |
 |
|||||
| 7 | Температура воздуха |
 |
 |
||||
 |
 |
||||||
| 8 | Внутренняя энергия |
 |
 |
2.
На графике в T—P координатах
наносят полученные точки и строят прямуюT
= aP,
коэффициент а
определяют по методу наименьших
квадратов.
3.
Пользуясь значением средней теплоёмкости,
по формуле (3.4) считают величину внутренней
энергии для каждого опыта. На начало
отсчёта внутренней энергии принимают
u=при t
= 0 C
 .
.
4.
Строят график

5.
Рассчитывают изменение внутренней
энергии
 для отдельных процессов.
для отдельных процессов.
Литература
- Артемов А. В. Физическая химия. — М.: Академия, 2013. — 288 с. — (Бакалавриат). — ISBN 978-5-7695-9550-9.
- Ипполитов Е. Г., Артемов А. В., Батраков В.В. Физическая химия / Под ред. Е. Г. Ипполитова. — М.: Академия, 2005. — 448 с. — (Высшее профессиональное образование). — ISBN 978-5-7695-1456-6.
- Лифшиц Е. М. // Физическая энциклопедия / Ред. А. М. Прохоров. — М.: Большая Советская Энциклопедия, 1992. — Т. 5. — С. 77–78.
- Лифшиц Е. М. // Большая советская энциклопедия / Ред. А. М. Прохоров. — 3-е издание. — М.: Большая Советская Энциклопедия, 1976. — Т. 25. — С. 451.
- Сивухин Д. В. Общий курс физики. — Издание 5-е, исправленное. — М.: Физматлит, 2006. — Т. II. Термодинамика и молекулярная физика. — 544 с. — ISBN 5-9221-0601-5.
- // Большая российская энциклопедия. — М.: Большая российская энциклопедия, 2016. — Т. 32. — С. 54.
Теплоемкость.
Теплоемкость – свойство материала поглощать определенное количество тепла при нагревании и выделять его при охлаждении.
Удельная теплоемкость – количество тепла, необходимое для нагревания единицы количества вещества на один градус.
Формула для расчёта удельной теплоёмкости (или табл.знач.):
,
где — удельная теплоёмкость,
— количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении),
— масса нагреваемого (охлаждающегося) вещества,
— разность конечной и начальной температур вещества.
В зависимости от единиц измерения количества вещества различают:
· массовую теплоемкость С , Дж / (кг К) — это количество теплоты, которое необходимо подвести к единице массы вещества, чтобы нагреть его на единицу температуры;
· объемную теплоемкость С’, Дж / (м3 К) — это количество теплоты, которое необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры;
· мольную теплоемкость СМ , Дж / (кмоль К) — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры.
Между различными видами теплоемкостей существует следующая зависимость:
С’ = СМ/22,4 ; С = СМ/М ; С = С’/ρ .
Различают среднюю (Сm) и истинную (С) теплоемкость:
Сm = q1-2/(t2–t1) , С = lim(q/t)=dq/dt=dq/dT,
где q1-2 – теплота, подводимая к газу в процессе нагревания от температуры t1 до температуры t2 .
Истинная теплоемкость – первая производная от количества теплоты, подводимой в процессе нагрева к телу, по его температуре.
Теплоемкость газа не постоянна. Она зависит от температуры и давления. Влияние давления на теплоемкость газов незначительное, поэтому обычно учитывают только влияние температуры.
Зависимости средней теплоемкости от температуры:
если тело нагревается от 0 до некоторой температуры t: Сm =a+bt/2;
если тело нагревается от температуры t1 до температуры t2: Сm =a+b(t1+t2),
где a, b, – коэффициенты, зависящие от природы газа, определяются экспериментально и приводятся в справочных таблицах.
Теплоемкость зависит от способа подвода теплоты к газу. Чаще всего используют 2 способа:
при V = const ( изохорный процесс ) — Cv;
при P = const ( изобарный процесс ) — Ср.
Теплоемкости при постоянном давлении и постоянном объеме связаны между собой следующими соотношениями:
Ср = Cv + R – уравнение Майера; Ср / Cv = к , (1)
где R — газовая постоянная, Дж /( кг К);
к — показатель адиабаты , зависит от количества атомов в молекуле газа: для одноатомных газов — к = 1,66; для двухатомных газов — к = 1,4; для трех- и многоатомных — к = 1,33 .
Анализ уравнений (1) показывает, что во время нагревания газа при P=const затрачивается тепла больше, чем при V=const.
Значение теплоемкости приближенно можно рассчитать следующим образом:
CV= R / (к — 1) ; CP= к R / (к – 1).
Массовую Ссм и объемную С’см теплоемость газовых смесей определяют по формулам:
Cсм = Σ (Ci gi ) ; C’см= Σ (C’i ri ) ,
где Ci– массовая теплоемкость отдельного газа, Дж/(кгК);
gi– массовые доли газов, составляющих смесь;
C’i– объемная теплоемкость отдельного газа, Дж/(м3К);
ri– объемные доли газов, составляющих смесь.
Количество теплоты, необходимое на нагрев тела, можно определить следующим образом:
Q = mС(t2-t1),
где С – удельная теплоемкость вещества.
Рассмотрим пример:
Газ (воздух) нагревается от начальной температуры t1=25oC до t2=130oC, масса газа m=21кг. Определить количество подведенного к воздуху тепла Q, считая удельную теплоемкость воздуха постоянной с=const=1,0301 кДж/кг·К. Выразить количество теплоты Q в килокалориях (ккал).
Решение:
Q = mС(t2-t1)=21·1,0301·(130-25)=2271 кДж·0,239=542,769ккал.
Ответ: Q = 2271 кДж=542,769ккал.
Теплоёмкость для различных процессов и состояний вещества код
Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа).
Теплоёмкость идеального газа | код
Основная статья: Теплоёмкость идеального газа
Теплоёмкость системы невзаимодействующих частиц (например, идеального газа) определяется числом степеней свободы частиц.
Молярная теплоёмкость при постоянном объёме:
- CV=dUdT=i2R,{\displaystyle C_{V}={dU \over dT}={\frac {i}{2}}R,}
где R{\displaystyle R} ≈ 8,31 Дж/(моль·К) — универсальная газовая постоянная, i{\displaystyle i} — число .
Молярная теплоёмкость при постоянном давлении связана с CV{\displaystyle C_{V}} соотношением Майера:
- CP=CV+R=i+22R.{\displaystyle C_{P}=C_{V}+R={{i+2} \over 2}R.}
Теплоёмкость кристаллов | код
Сравнение моделей Дебая и Эйнштейна для теплоёмкости твёрдого тела
Существует несколько теорий теплоёмкости твердого тела:
- Закон Дюлонга — Пти и закон Джоуля — Коппа. Оба закона выведены из классических представлений и с определенной точностью справедливы лишь для нормальных температур (примерно от 15 °C до 100 °C).
- Квантовая теория теплоёмкостей Эйнштейна. Первое применение квантовых законов к описанию теплоёмкости.
- Квантовая теория теплоёмкостей Дебая. Содержит наиболее полное описание и хорошо согласуется с экспериментом.
Изохорная теплоемкость
| Изменение энтропии ds. |
Вычислим изохорную теплоемкость влажного водяного пара, имеющего степень сухости х 0 575 при давлении 1 бар. Поданным опытов А. М. Керимова, теплоемкости су и су при давлении р 1 бар равны соответственно 1 007 и 16 95 ккал / кг. Непосредственное вычисление по таблицам водяного пара дает значение cv 10 1 ккал / ( кг — град), практически не отличающееся от экспериментального.
Так как изохорная теплоемкость влажного пара cv — величина положительная, то это значит, что знаки дифференциалов dp и dv противоположны.
Так как изохорная теплоемкость влажного пара cv — величина положительная, то величины dp и dv — противоположны. Таким образом, изоэнтропическое расширение влажного пара обусловливает уменьшение его давления и температуры, а изоэнтропическое сжатие — возрастание их.
Так как изохорная теплоемкость влажного пара с есть положительная величина, то отсюда следует, что знаки дифференциалов dp и dv противоположны.
Результаты исследований изохорной теплоемкости на изохорах, проведенные вдали от критической точки v 2 67; 2 92; 4 95; 5 96; 9 92 см3 / г, показывают, что теплоемкость cv с увеличением температуры монотонно увеличивается, достигает некоторого своего максимального значения при определенной температуре, затем происходит скачкообразное ее уменьшение, что является признаком совершения перехода из двухфазного состояния в однофазное через пограничную кривую. В однофазной области в исследованном температурном интервале теплоемкость с на изохорах раствора данной концентрации с увеличением температуры монотонно уменьшается. Установлено, что величины теплоемкости сс в двухфазной области и их разрыв при переходе в однофазное состояние с ростом значения v возрастают.
Экспериментальное исследование изохорной теплоемкости некоторых углеводородов и спиртов.
Характер сингулярности изохорной теплоемкости одноком понентной жидкости таков, что до сих пор можно встретит утверждения, основанные на рассмотрении искаженного участ ка аномалии, об отсутствии расходимости этой величины в кри тической точке.
Уравнение для изохорной теплоемкости са записывается следующим образом ( г V сопз.
Следовательно, изохорную теплоемкость можно определить как количество теплоты, которое необходимо подвести к системе при постоянном объеме, чтобы повысить ее температуру на один градус.
Здесь Су — изохорная теплоемкость в идеальном состоянии, отнесенная к одной частице газа; Л, Л / — число положительных ионов и электронов.
Покажите, что изохорная теплоемкость этого газа не зависит от объема.
С г — изохорная теплоемкость газа; i CPICV; Pt и Р2 — начальное и конечное давление; СР — изобарная теплоемкость газа; TI и TZ — начальная и конечная температура; Vi и У2 — — начальный и конечный объем.
| Зависимость изохорной теплоемкости от температуры для простых кристаллических веществ.| Изобарная теплоемкость металлов. |
Таким образом, изохорная теплоемкость кристалла простого вещества должна быть равна 25 Дж / ( К-моль), Это правило соблюдается только при достаточно высоких температурах для многих металлов, начиная с четвертого периода системы элементов. Чем больше атомная масса элемента, тем при более низкой температуре достигается теоретическое значение теплоемкости. Теплоемкость алмаза не достигает этого значения даже при 1200 С.
Теплоотдача и терморегуляция
Количество
теплоты Q,
переносимое вследствие теплопроводности
за время Δt,
определяется формулой
Q=k1ΔTΔSΔt/Δx
где
k1—
коэффициент теплопроводности; ΔT/Δx
— градиент тем-
пературы
в направлении, перпендикулярном площадке
ΔS.
Количество
теплоты Q,
переносимое вследствие конвекции за
время Δt,
определяется формулой;
Q=k2(T-T)ΔSΔt
где
k2
— коэффициент теплопередачи при
конвекции; Т и Т
— соответственно
температуры поверхности ΔS
и омываемой среды.
Количество
теплоты Q,
излучаемое за время Δt
абсолютно черным телом, определяется
формулой (закон Стефана — Больцмана)
Q=σT4ΔSΔt
где
σ—
постоянная Стефана — Больцмана; Т
— абсолютная температура
тела; ΔS
— площадь излучающей поверхности тела.
Для
реальных физических тел закон Стефана
— Больцмана имеет
вид
Q=k3σT4ΔSΔt
где
k3
— коэффициент, учитывающий, что свойства
поверхности реальных
физических тел отличны от свойств
поверхности абсолютно
черного тела (k3<. k>3=
1.
При
наличии двух встречных потоков радиации
от излучающей
поверхности к среде и от среды к
поверхности закон Стефана
— Больцмана имеет вид
Q=k3σ(T4–T4)ΔSΔt
где
Т и Т
— абсолютные температуры тела и
среды; ΔS
— площадь
излучающей поверхности тела.
Длина
волны λт,
которой соответствует максимум
излуча-тельной способности черного
тела, обратно пропорциональна абсолютной
температуре Т (закон смещения Вина):
λm=b/T
где
b
— постоянная закона смещения Вина.